Colegio San Ignacio de Loyola
Castilla - Piura - Perú
Proyecto ABP - Aulas Virtuales
Grupo: Los Grotsos
Dueto: Jesús Seminario Encalada--->4º "A"
------- Erick Vargas Seminario -----> 4º "A"
PREGUNTAS:

1.- ¿Cómo se origina la corriente eléctrica?
HISTORIA
La corriente eléctrica fue descubierta a finales del siglo XVIII e investigada por los italianos Luigi Galvani y Alessandro Volta. En 1793, Galvani se encontraba realizando una clase, donde había seccionado y preparado una rana, la que posteriormente fijó sobre un mesón de laboratorio, en el que había una máquina de electrificación. Él observó la contracción del músculo de la rana al ser tocada por un escarpelo, y asoció el fenómeno a la máquina. A partir de esta experiencia, preparó varias ranas y las colgó con ganchos de bronce en su propia reja de fierro, y mientras ocurría una tormenta una de las patas hizo contacto entre la reja y el gancho, produciéndose nuevamente el mismo fenómeno. Galvani creyó erróneamente que el muslo de la rana había almacenado electricidad, la que denominó electricidad animal, y que se descargaba al contacto con ambos metales.
Años más tarde, Alessandro G. Volta supuso lo contrario, y propuso que era el contacto entre metales distintos lo que generaba electricidad. Esto lo instó a construir el primer dispositivo químico generador de electricidad, al que denominó batería eléctrica, conocido actualmente como pila, permitiendo obtener por primera vez en la historia una corriente continua.

Posteriormente, el físico danés Hans Christian Oersted, hizo pasar una determinada corriente eléctrica por un alambre y lo acercó a una aguja imantada. La aguja se desvió hacia un lado, apartándose de su posición inicial y hacia el otro cuando la corriente fue dirigida en sentido inverso, demostrando con esto, que una corriente generaba un campo magnético.

ORIGEN
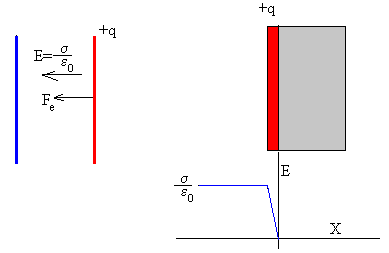
La corriente eléctrica es el flujo de portadores de carga eléctrica, normalmente a través de un cable metálico o cualquier otro conductor eléctrico, debido a la diferencia de potencial creada por un generador de corriente.

En un circuito eléctrico cerrado la
corriente circula siempre del polo
negativo al polo positivo de la
fuente de fuerza electromotriz (FEM)
COMENTARIO
La corriente electrica es la circulación de cargas o electrones a través de un circuito eléctrico cerrado, que se mueven siempre del polo negativo al polo positivo de la fuente de suministro de fuerza electromotriz (FEM). Fue descubierta casualmente por Luigi Galvani, diseccionaba una rana cuando su ayudante produjo una chispa que causó una corriente electrica y esto le causó un calambre. En un principio la llamó electricidad animal.
Citas y Referencias Bibliográficas
1.- Wikipedia - Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/Corriente_eléctrica
2.- Monografías - Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos11/coele/coele.shtml
3.- Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://www.asifunciona.com/electrotecnia/ke_corriente_electrica/ke_corriente_electrica_1.htm
4.- Origen de la corriente electrica - Página consultada el día 15/11/06 - Disponible en la web: http://www.astrocosmo.cl/electrom/electrom-03.htm
2.- Clases de corriente eléctrica
Las clases de corriente eléctrica son dos la continua y la alterna, veamos:
CORRIENTE CONTINUA
Son circuitos en los cuales la corriente que circula por ellos, mantiene su sentido y su valor. Son alimentados por una fuente o batería que entrega una f.e.m. continua.
Circuitos de corriente continua (c.c.)
Los circuitos de corriente continua son alimentados con baterías que entregan una f.e.m. constante. En un circuito formado solo por resistores en serie (recuerda que los cables y la fuente de poder también tienen resistencia), la intensidad de corriente en un elemento no varía y el voltaje es directamente proporcional a la intensidad de corriente. Si el circuito está formado además por condensadores e inductores, la intensidad de corriente cambia en el tiempo.
Circuito RC
Es un circuito eléctrico de corriente continua formado por un resistor de resistencia R, que limita el paso de la corriente, y un condensador de capacidad C, inicialmente descargado, al que se han conectado un amperímetro y un voltímetro. Al cerrar el interruptor, el condensador se carga. Más adelante se analizará la etapa de carga y descarga de un condensador, en un circuito RC.
CORRIENTE ALTERNA
Son circuitos en los cuales la corriente que circula por ellos, y su valor, cambia su sentido periódicamente. Son alimentados por una fuente o batería que entrega una f.e.m. alterna.
Circuitos de corriente alterna (a.c.)
Los generadores de corriente continua se llaman dínamos. Los de corriente alterna se llaman alternadores, estos entregan una f.e.m. cuya polaridad se va alternando regularmente en el tiempo. En ambos casos se transforma la energía mecánica en eléctrica, al contrario de los motores eléctricos.
Circuitos LC
El modelo más simple de un circuito de corriente alterna es aquel que se obtiene al conectar
un condensador de capacidad C, con una carga inicial Q0, y una bobina de inductancia L. Estos circuitos se denominan circuitos oscilantes o simplemente LC, ya que: suponiendo despreciable la resistencia del circuito, la corriente (I) y el voltaje (V) comenzarán a oscilar indefinidamente de modo que cuando I es máximo, V es mínimo, y viceversa.
COMENTARIO
Las clases de corriente eléctrica son dos la continua y la alterna.
Citas y Referencias Bibliográficas
1.- Monografías - Nociones Fundamentales de la electricidad - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos10/nofu/nofu.shtml
2.- Rincón del Vago - Electrónica - Página consultada el día 15/11/06 - Disponible en la web: http://html.rincondelvago.com/mediciones-electricas_voltaje-de-corriente-alterna.html
3.- Rincón del vago - Electrónica - Página consultada el día 15/11/06 - Disponible en la web: http://html.rincondelvago.com/instalacion-electrica-de-una-vivienda.html
4.- Electrónica2000 - Electricidad - Página consultada el día 15/11/06 - Disponible en la web: http://www.electronica2000.com/temas/pregresp.htm
3.- Elementos de la electrólisis.
La Electrólisis es la descomposición de una sustancia por medio de la corriente eléctrica. Los elementos indispensables para que se produzca la electrólisis son el electrolito, los electrodos y la celda electrolítica.
Electrolito.- Es toda sustancia iónica que en solución se descompone al pasar la corriente eléctrica. Cuerpo que se somete a electrólisis.
Los electrolitos son fuertes cuando dejan pasar fácilmente la corriente eléctrica, pero cuando no lo hacen sino la dejan pasar débilmente, esto es por contener pocos iones, es decir que no son fuertes.
Electrodo.- Componente de un circuito eléctrico que conecta el cableado convencional del circuito a un medio conductor como un electrólito o un gas. La batería seca común utiliza un ánodo de carbono y un cátodo de cinc en contacto con una disolución electrolítica. Los electrodos de arco voltaico están fabricados con carbono y los electrodos empleados en la soldadura por arco están elaborados con un metal revestido de fundente. Los electrodos de los tubos de vacío están fabricados con carbono y diversos metales y aleaciones, según el uso al que estén destinados. En el caso más cercano a la electrólisis; son conductores metálicos sumergidos en el electrolito.
Celda electrónica.- Es un recipiente que contiene la solución electrolítica y los electrodos.
COMENTARIO
Los elementos indispensables para que se produzca la electrólisis son el electrolito, los electrodos y la celda electrolítica.
Citas y Referencias Bibliográficas
1.- Wikipedia - Electrólisis - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/Electrólisis
2.- UC - Electrólisis - Página consultada el día 15/11/06 - Disponible en la web: http://www.uc.cl/quimica/agua/act3.htm
3.- Rincón del Vago - Electrólisis - Página consultada el día 15/11/06 - Disponible en la web: http://html.rincondelvago.com/electrolisis_2.html
4.- Rincón del Vago - Electroquimica - Página consultada el día 15/11/06 - Disponible en la web: http://html.rincondelvago.com/electroquimica.html
4.- Investigadores,científicos que han aportado al estudio y desarrollo de la electricidad.
LUIGI GALVANI

Citas y Referencias Bibliográficas
1.- Personajes - Página consultada el día 15/11/06 - Disponible en la web: http://omega.ilce.edu.mx:3000/sites/ciencia/volumen3/ciencia3/160/htm/sec_4.htm
2.- Wikipedia - Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/Corriente_eléctrica
3.- Monografías - Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos11/coele/coele.shtml
4.- Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://www.asifunciona.com/electrotecnia/ke_corriente_electrica/ke_corriente_electrica_1.htm
5.- ¿Qué es la electroquímica?
Se subdivide en dos clases:
1) Estudia las reacciones químicas que producen una corriente de electricidad (batería)
2) Estudia las reacciones químicas que son producidas por una corriente eléctrica (electrólisis)
Las reacciones electroquímicas son reacciones de oxidorreducción.
Es la parte de la química que trata de la relación entre las corrientes eléctricas y las reacciones químicas, y de la conversión de la energía química en eléctrica y viceversa. En un sentido más amplio, la electroquímica es el estudio de las reacciones químicas que producen efectos eléctricos y de los fenómenos químicos causados por la acción de las corrientes o voltajes.
COMENTARIO
La electroquímica es la parte de la química que estudia las reacciones químicas que producen corrientes eléctricas y viceversa. En general, la electroquímica es el estudio de las reacciones químicas que producen efectos eléctricos y de los fenómenos químicos causados por la acción de las corrientes o voltajes.
Citas y Referencias Bibliográficas
1.- Encarta - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://es.encarta.msn.com/encyclopedia_761569809/ElectroquÃmica.html
2.- Monográficas - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos7/elec/elec.shtml
3.- Rincón del Vago - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://html.rincondelvago.com/electroquimica.html
4.- Wikipedia - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/ElectroquÃmica
6.- Unidades electoquímicas
Citas y Referencias Bibliográficas
1.- Encarta - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://es.encarta.msn.com/encyclopedia_761569809/ElectroquÃmica.html
2.- Monográficas - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos7/elec/elec.shtml
3.- Rincón del Vago - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://html.rincondelvago.com/electroquimica.html
4.- Wikipedia - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/ElectroquÃmica
7.-.- Describe las leyes de la electroquímica.
Entre 1800-1830 Michael Faraday físico y químico ingles, realizó estudios cuantitativos referente a la relación entre la cantidad de electricidad que pasa por una solución y resultado de sus investigaciones las enuncio entre los años 1833-1834 en las leyes que tienen su nombre.



Citas y Referencias Bibliográficas
1.- Encarta - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://es.encarta.msn.com/encyclopedia_761569809/ElectroquÃmica.html
2.- Monográficas - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos7/elec/elec.shtml
3.- Rincón del Vago - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://html.rincondelvago.com/electroquimica.html
4.- Wikipedia - Electroquímica - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/ElectroquÃmica
8.- Básicamente, grafica y explica las partes de una batería o pila desde la física y la química.


Los elementos que forman una batería se ven el la figura de arriba. El liquido que hay dentro de la batería, se llama electrólito esta compuesto por una mezcla de agua destilada y acido sulfúrico, con una proporción del 34% de acido sulfúrico y el resto de agua destilada. El nivel del electrólito debe de estar un centímetro por encima de las placas.


Citas y Referencias Bibliográficas
1.- Wikipedia - Bateria - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/BaterÃa_eléctrica
2.- Wikipedia - Bateria Eléctrica - Página consultada el día 15/11/06 - Disponible en la web: http://enciclopedia.us.es/index.php/Batería_eléctrica
3.- Monografías - Pila o Bateria - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos26/la-pila/la-pila.shtml
4.- Monográficas - Pila - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos11/pila/pila.shtml
9.- En una pila o batería, hay compuestos que reaccionan. Explica y escribe las ecuaciones que suceden.
Acoplamiento de bateríasunión:
Para conseguir mayores tensiones (V) o una capacidad de batería (Amperios-hora Ah) distintos a los estándares que tienen las baterías que encontramos en el mercado, se utiliza la técnica de unión de baterías:
Esta unión puede ser mediante:
- Acoplamiento serie:
Tiene como característica principal que se suman las tensiones de las baterías y la capacidad permanece igual. Como punto a tener en cuenta en este acoplamiento es que la capacidad de la batería (Ah) debe ser la misma para todas las baterías.
Si una de ellas tuviera menor capacidad, durante el proceso de carga de las baterías, este elemento alcanzaría la plena carga antes que los demás por lo que estaría sometido a una sobrecarga, cuyos efectos pueden deteriorar la batería. También durante el proceso de descarga la batería de menor capacidad se descargara antes por lo que se pueden sulfatar sus placas.
- Acoplamiento paralelo:
Tiene como característica principal que se suman las capacidades de la batería manteniendose invariable las tensiones. Como punto a tener en cuenta en este acoplamiento es que todas las baterías deben de tener igual valor de tensión (V) en sus bornes de no ser así la de mayor tensión en bornes se descargara a través de la de menor.
- Acoplamiento mixto:
Consiste en unir baterías en serie con otras en paralelo para así conseguir así la suma de las ventajas de cada uno de los acoplamientos.

El voltaje de una pila alcalina es cercano a 1,5 v. Durante la descarga, las reacciones en la celda seca alcalina son :
Ánodo : Zn(S) + 2 OH- (ac) ® Zn(OH)2(s) +2 e-
Cátodo : 2 MnO2 (S) + 2 H2 O (l) + 2 e- ® 2MnO (OH) (s) + 2 OH-(ac)
--------------------------------------------------------------------------------
Global : Zn(s) +2 MnO2 (s) 2H2O(l) ® Zn(OH)2(ac) + 2MnO (OH) (s)
El ánodo está compuesto de una pasta de zinc amalgamado con mercurio (total 1%),carbono o grafito.
Se utilizan para aparatos complejos y de elevado consumo energético. En sus versiones de 1,5 voltios, 6 voltios y 12 voltios, se emplean, por ejemplo, en mandos a distancia (control remoto) y alarmas.
Citas y Referencias Bibliográficas
1.- Wikipedia - Bateria - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/BaterÃa_eléctrica
2.- Wikipedia - Bateria Eléctrica - Página consultada el día 15/11/06 - Disponible en la web: http://enciclopedia.us.es/index.php/Batería_eléctrica
3.- Monografías - Pila o Bateria - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos26/la-pila/la-pila.shtml
4.- Monográficas - Pila - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos11/pila/pila.shtml
10.- En nuestro cuerpo, ¿existe corriente eléctrica: ¿Cómo se presenta? ¿Dónde es más notoria?
Nuestro cuerpo funciona mediante impulsos eléctricos. Podemos comprobar que algunos están asociados al funcionamiento de corazón, (ECG), y otros al funcionamiento del cerebro (EEG). Las leyes de la física se aplican como a cualquier otra sustancia material. Cuando una corriente eléctrica circula por un cable, siempre existe un campo electromagnético alrededor. De esto se deduce que existe una corriente eléctrica circulando por nuestro cuerpo con su energía electromagnética asociada. Actualmente se puede visualizar ese campo mediante la fotografía Kirlian.
Los científicos occidentales están investigando mucho en la actualidad estas nuevas ideas sobre Anatomía, Fisiología, Bioquímica, etc. Estos campos energéticos de nuestro cuerpo, controlan numerosas funciones diferentes: mentales, emocionales, etc. En el caso de una salud perfecta, todos los sistemas del cuerpo reciben una información adecuada gracias a una circulación energética correcta; sin embargo, nuestro cuerpo puede estar sometido a un gran stress, no haber una buena circulación energética y por tanto, algo que debe ser corregido.

Citas y Referencias Bibliográficas
1.- Wikipedia - Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://es.wikipedia.org/wiki/Corriente_eléctrica
2.- Monografías - Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://www.monografias.com/trabajos11/coele/coele.shtml
3.- Corriente Electrica - Página consultada el día 15/11/06 - Disponible en la web: http://www.asifunciona.com/electrotecnia/ke_corriente_electrica/ke_corriente_electrica_1.htm
4.- Origen de la corriente electrica - Página consultada el día 15/11/06 - Disponible en la web: http://www.astrocosmo.cl/electrom/electrom-03.htm
GLOSARIO
ÁCIDO
Especie química que libera iones hidrógeno, H+. (Definición de Löwry- Brönsted, que en este respecto coincide con la definición clásica de Arrhenius).
ACUMULADOR
Cualquier elemento productor de energía eléctrica basado en una/s pila/s secundaria/s (acumulador equivale a recargable).
AMPERE
Es la intensidad de una corriente eléctrica constante que, mantenida en dos conductores paralelos, rectilíneos, de longitud infinita, de sección circular despreciable y colocados en el vacío a una distancia de un metro uno de otro, produce entre estos dos conductores una fuerza igual a 2 x 10-7 Newton por metro de longitud.
ANIÓN
Ion que posee carga negativa.
ANODO
Electrodo en el que tiene lugar la oxidación en una celda electroquímica.
ATOMOS
Las partículas más pequeñas que poseen las propiedades de un elemento; toda la materia está compuesta de átomos.
AVOGADRO,
LEY DE Volúmenes iguales de gases a la misma temperatura y presión contienen el mismo número de moléculas.
BASE
Especie química que capta iones hidrógeno, H+. (Definición de Löwry- Brönsted).
BATERIA Unidad productora de energía eléctrica constituida por varias pilas.
BOYLE, LEY DE
A presión constante, el producto de la presión y el volumen de una muestra dada de gas es constante.
CAPA DE VALENCIA
Nivel de energía de un átomo que determina sus propiedades químicas, en particular la formación de enlaces.
CATALIZADOR
Sustancia que acelera una reacción química pero no sufre cambios.
CATIÓN
Ion que posee carga positiva.
CÁTODO
En una celda electroquímica, el electrodo en el que tiene lugar la reducción.
CELDA ELECTROQUÍMICA
Dispositivo para llevar a cabo una electrólisis o producir electricidad por medio de una reacción química.
CELDA VOLTAICA
Celda electroquímica en la que se emplea una reacción química espontánea para producir electricidad.
COMPUESTO COVALENTE
Compuesto que contiene sólo enlaces covalentes.
COMPUESTO IÓNICO
Sustancia compuesta por iones.
CONCENTRACIÓN
Cantidad de soluto disuelto en una cantidad específica de disolvente o disolución.
CONDUCTIVIDAD ELÉCTRICA
Capacidad para conducir una corriente eléctrica.
CONDUCTOR
Material que permite que la electricidad fluya.
CONFIGURACIÓN ELECTRÓNICA
Distribución de los electrones en los diversos niveles energéticos de un átomo, ión o molécula.
COULOMB
Es la cantidad de electricidad transportada en 1 segundo por una corriente de 1 ampere.
CHARLES, LEY DE
A presión constante, el volumen de una muestra dada de gas es directamente proporcional a la temperatura kelvin.
CORRIENTE
Flujo de electrones.
DENSIDAD
La masa por unidad de volumen de un material dado.
DISOLUCIÓN AMORTIGUADORA
Solución que contiene un ácido o base débil y una de sus sales, que tiene la propiedad de mantener el pH dentro de un estrecho rango cuando se le adicionan cantidades discretas de ácidos o bases. Se les llama también disoluciones “buffer” o tampón.
ECUACIÓN IÓNICA NETA
Ecuación que muestra solamente las sustancias químicas que participan en una reacción en la que intervienen iones en disolución acuosa.
ECUACIÓN QUÍMICA
Combinación de fórmulas químicas que representa lo que ocurre en una reacción química, por ejemplo, 2 H2(g) + 02(g) = 2H20(g).
ELECTROAFINIDAD
Es la energía asociada a la captación de un electrón por la capa de valencia de un átomo. Se le asigna arbitrariamente un signo algebraico contrario al convencional.
ELECTRODOS
Dos tiras de metal o de otros conductores, que actúan como contactos entre la disolución o la sal fundida y el circuito externo en una celda electroquímica; la reacción tiene lugar en ambos electrodos.
ELECTRÓFILO
Especie que presenta alguna deficiencia de electrones o que tiene carga positiva y que se enlaza a átomos, particularmente carbono, en especies de alta densidad de carga electrónica o con carga negativa.
ELECTROLITO
El electrolito de una pila puede ser un líquido o una pasta en el primer caso, la cera se llama a menudo pila húmeda. Las pilas en la que el electrolito es una pasta se denomina pilas secas.
ELECTRÓN
Partícula con carga negativa, presente en todos los átomos. Partícula fundamental de la materia, tiene una carga negativa de 1,602176462 × 10-19
culombios ± 0,000000063 × 10-19 culombios y una masa de 9,10938188 × 10-31
kg ± 0,00000072 × 10-31 kg.
ELECTRONEGATIVIDAD
Capacidad de un átomo, en una molécula, para atraer los electrones hacia sí.
ELECTRÓLISIS
Uso de la energía eléctrica para hacer que ocurra una reacción de oxidación- reducción no espontánea.
ELEMENTOS
Sustancias químicas fundamentales, de las cuales están formadas todas las demás sustancias.
ENERGÍA CINÉTICA
Energía asociada al movimiento de un objeto.
ENERGÍA DE ACTIVACIÓN
Energía mínima requerida para la colisión fructífera de partículas de reactivos
en una reacción química.
ENERGÍA DE ENLACE
Energía necesaria para romper un enlace. Por lo general se refiere a 1 mol de enlaces y se expresa en kJ • mol–1.
ENERGÍA DE IONIZACIÓN
Energía necesaria para desprender un electrón de un átomo aislado, al estado gaseoso. Corresponde a la energía involucrada en el proceso:M M+ + e–
ENLACE COVALENTE
Fuerza que mantiene muy unidos dos átomos, y que se presenta cuando dichos átomos comparten uno o más pares de electrones.
ENLACE IÓNICO
Atracción entre iones con carga opuesta en un compuesto iónico.
ENLACE METÁLICO
Enlace formado por elementos metálicos, que es fuertemente deslocalizado.
ENLACE QUÍMICO
Fuerza que mantiene unidos los átomos o iones en los compuestos químicos.
ESTADO
La forma (gas, líquido o sólido) en la que se halla la materia.
ESTADO GASEOSO
Estado de la materia que no posee volumen o forma fijos.
ESTADO O NÚMERO DE OXIDACIÓN
Se define formalmente, para un átomo en un compuesto binario, como el número de electrones que gana o pierde dicho átomo para formar un compuesto.
ESTEQUIOMETRÍA
Proporción en que los elementos o compuestos reaccionan entre sí.
ESTRUCTURA DE LEWIS
Representación de los electrones de la capa de valencia de un átomo mediante puntos. Los enlaces covalentes simples entre dos átomos se representan por un par de puntos o por un trazo, los enlaces dobles por dos pares de puntos o por dos trazos y así sucesivamente.
EXOTÉRMICO
Proceso que libera energía.
ENERGÍA INTERNA
Comprende todas las formas de energía de un sistema y se compone de las energías propias de las partículas y de sus interacciones.
ESTADO O NÚMERO DE OXIDACIÓN
Se define formalmente, para un átomo en un compuesto binario, como el número de electrones que gana o pierde dicho átomo para formar un compuesto.
ESTEREOQUÍMICA
Representación de una molécula en el espacio tridimensional, de modo que refleja la real ubicación de sus átomos o grupos atómicos.
FAMILIA (TABLA PERIÓDICA)
Columna vertical de elementos en la tabla periódica; también llamada grupo; los miembros de una familia tienen propiedades similares.
FÓRMULA DE ELECTRÓN-PUNTO
Fórmula de una sustancia, en la que puntos que representan los electrones exteriores de cada átomo muestran los pares electrónicos compartidos entre átomos.
FÓRMULA ESTRUCTURAL
Fórmula química que muestra el arreglo de los átomos y los enlaces covalentes en una molécula.
FÓRMULA QUÍMICA
Combinación de símbolos que representa los elementos presentes en una sustancia, y en la que los subíndices muestran el número de átomos de cada elemento; por ejemplo, la fórmula del amoniaco es NH3.
GAS NOBLE
Elemento del grupo 18, He, Ne, Ar, Kr, Xe, Rn. Los gases nobles se caracterizan por sus niveles “np” completos (a excepción del He que completa
la capa 1s) y son elementos de escasa, pero no nula, reactividad química. Por ello no se deben denominar “gases inertes”.
GRUPO FUNCIONAL
Conjunto de átomos enlazados de una determinada manera, que caracteriza el comportamiento físico-químico de las moléculas que lo contienen. Ejemplos típicos son los grupos funcionales ácido carboxílico, - C(O)OH, alcohol, -OH, y éster, - C(O)O-R.
GRUPO (TABLA PERIÓDICA) (Ver familia).
HIBRIDACIÓN
Combinación algebraica de orbitales atómicos de energía similar, para generar un número equivalente de orbitales “mezclados” o “híbridos”.
HIDRATACIÓN
Fenómeno por el cual un ión o molécula se rodea de moléculas de agua. Para el caso general de cualquier disolvente el proceso se denomina solvatación.
INDICADOR ÁCIDO-BASE
Sustancia que manifiesta un cambio (por lo general de color) a determinado valor de la concentración de iones H+ en la disolución.
ION
Átomo o grupo de átomos que ha quedado cargado eléctricamente al perder o ganar electrones.
ION MONOATÓMICO
Especie eléctricamente cargada que consiste de sólo un átomo.
ION POLIATÓMICO
Especie eléctricamente cargada consistente de dos o más átomos.
ISÓMEROS GEOMÉTRICOS Moléculas con idéntico número de átomos y enlaces, pero con diferente distribución espacial.
ISÓTOPOS
Átomos del mismo elemento pero con distinto número de neutrones.
IRREVERSIBILIDAD
En un sentido no riguroso2 alude a la calidad de procesos (irreversibles) en un sistema que ocurren cuando se alteran las condiciones del entorno, en una dirección pero no en dirección contraria.
LLUVIA ÁCIDA
Precipitación de agua ácida desde las nubes, por formación de ácido sulfúrico y nítrico en la atmósfera.
MASA ATÓMICA
La masa de un átomo.
MASA MOLAR
Masa (por lo general en gramos) de un mol de una sustancia.
MATERIA
Lo que tiene masa y ocupa lugar en el espacio.
MEDIA CELDA
Metal (u otro material que actúa como electrodo) y la disolución de sus iones que lo rodea en una celda voltaica.
MOL
Cantidad de una sustancia o especie química igual a 6.02 x 1023 unidades, las cuales pueden ser átomos, moléculas, unidades de fórmula, electrones u otras entidades específicas.
MOLÉCULA
Partícula más pequeña de una sustancia química que conserva sus covalentes.
MECANISMO DE REACCIÓN
Descripción de una secuencia de eventos que se postula que ocurren a nivel molecular cuando los reactantes se transforman en productos.
MÉTODO DEL ION ELECTRÓN
Procedimiento de igualación que se aplica primero, independientemente, a las ecuaciones de las semi-reacciones de oxidación y de reducción. En una segunda etapa éstas se relacionan para representar la reacción completa de óxido-reducción (o redox), cuidando que el número de electrones cedidos en la semirreacción de oxidación sea igual al número de electrones aceptados en la reducción.
METALES
Elementos de brillo característico, que conducen bien la corriente eléctrica y el calor.
METALOIDE
Elemento con propiedades intermedias a las de los metales y los no metales. Su conductividad eléctrica aumenta al elevar la temperatura.
MÉTODO DEL ION ELECTRÓN
Procedimiento de igualación que se aplica primero, independientemente, a las Ecuaciones de las semi-reacciones de oxidación y de reducción.
En una segunda etapa éstas se relacionan para representar la reacción Completa de óxido-reducción (o redox), cuidando que el número de electrones cedidos en la semirreacción de oxidación sea igual al número de electrones aceptados en la reducción.
MODELO PLANETARIO
Modelo que describía al átomo como un diminuto sistema solar, en el que los electrones giraban alrededor del núcleo de manera análoga a como lo hacen los planetas alrededor del sol. Este modelo fue superado ya que no corresponde a una realidad física.
MOLALIDAD
Unidad de concentración de disoluciones que se define como el número de
moles de soluto disuelto en 1 kilogramo de solvente.
MOLARIDAD
Unidad de concentración definida por el número de moles de soluto o de especies iónicas en 1 litro de solución.
NEUTRÓN
Partícula neutra presente en los núcleos de la mayoría de los átomos. Localizada en el núcleo atómico de todos los átomos excepto el hidrógeno. Los neutrones no tienen carga eléctrica pero poseen una masa de 1,008665 uma
NO METAL
Elemento que es mal conductor del calor y de la electricidad.
NÚMERO ATÓMICO
El número de protones de un átomo; permite distinguir los átomos de distintos elementos.
NÚMERO DE MASA
Suma del número de protones y neutrones en un átomo de un isótopo especifico.
NUCLEÓFILO
Especie que presenta un par electrónico no compartido o con carga negativa, que específicamente ataca a un átomo, generalmente de carbono, de una molécula que exhibe baja densidad de carga electrónica o carga positiva.
NÚMERO DE AVOGADRO 6,0223
• 1023. Es el número de partículas en 1 mol.
ORBITAL
Se puede definir como una región del espacio alrededor del núcleo atómico que puede estar ocupada por 1 ó 2 electrones. (Esta no es una definición rigurosa, ya que el orbital es una función matemática o función de onda característica, que es solución de la ecuación de ondas de Schrödinger. Para el caso de un átomo se designan como orbitales atómicos, mientras que en las moléculas se conocen con el nombre de orbitales moleculares).
OSMOSIS
Paso de moléculas de solvente a través de una membrana semipermeable, que se manifiesta por un flujo neto de solvente desde una solución diluida o desde el solvente puro hacia una solución más concentrada.
OSMOSIS INVERSA
Es el fenómeno inverso al espontáneo de osmosis y se logra aplicando una presión a una solución concentrada de modo que moléculas de solvente pasen a través de una membrana semipermeable hacia otra solución más diluida o hacia el solvente puro.
OXIDOS
Compuestos químico formados por oxígeno y otros elemento.
OXIDACIÓN
Proceso que involucra, formalmente, la cesión de uno o más electrones por parte de un átomo (o un grupo de átomos). Se dice que éste (o éstos) se oxida(n).
PERÍODOS
(TABLA PERIÓDICA) Filas horizontales de elementos en la tabla periódica.
pH
Se define como el valor negativo del exponente de la concentración molar de iones H+ de una disolución, expresada en base 10.
PILAS PRIMARIAS
Pila basada en una reacción química irreversible, y por lo tanto, no recargable (posee un sólo ciclo de vida).
PILAS SECUNDARIAS
Pila basada en una reacción química reversible y, por lo tanto, recargable. Se pueden regenerar sus elementos activos pasando una corriente eléctrica en sentido contrario al de descarga. Posee ciclos de vida múltiples.
PRECISIÓN
Grado de concordancia obtenido en la realización de varias mediciones de una misma cantidad.
POLARIDAD DE ENLACE
Propiedad permanente de un enlace la que se manifiesta por una separación parcial de carga eléctrica determinada por la diferente electronegatividad de los átomos unidos.
PRINCIPIO DE CONSTITUCIÓN DE BOHR
Establece que en la construcción de la estructura electrónica de un átomo los electrones ocupan primero los niveles inferiores de menor energía y, sucesivamente, a medida que éstos se van completando, los niveles superiores de mayor energía. Se le llama también principio de “Aufbau”.
PRINCIPIO DE EXCLUSIÓN DE PAULI
Los electrones siempre ocupan un orbital con espin opuesto, de modo que éste jamás puede ser ocupado por más de dos electrones. (Ello debido a que el número de espin asociado al electrón tiene sólo dos valores posibles y un tercer electrón tendría, necesariamente, su número de espin igual al de alguno de los otros dos).
PRINCIPIO DE MÁXIMA, MULTIPLICIDAD DE HUND
Principio que establece que los electrones en un átomo ocupan varios niveles de idéntica energía de modo tal que su número de espin total, comprendido como la suma de los números de espin de los electrones individuales, es máximo.
PROBABILIDAD
Cociente entre el número de eventos favorables a un determinado suceso y el número total de eventos que pueden ocurrir.
PRODUCTO
Sustancia que se forma en una reacción química.
PRODUCTO IÓNICO DEL AGUA
Producto de las concentraciones molares de iones H+ y OH- y que tiene un valor constante, dependiendo de la temperatura. En rigor depende también de la concentración de sales y/o de la presencia de otros solutos como alcohol.
PROPIEDADES PERIÓDICAS
Propiedades de los átomos de los elementos químicos que se repiten en forma regular o cíclica cuando se representan vs. su número atómico.
PROTÓN
Partícula con carga positiva presente en el núcleo de todos los átomos, se encuentra localizada en el núcleo atómico. Tiene carga positiva igual y de signo opuesto a la del electrón. Los protones tienen una masa de 007276
uma.
PUNTO DE CONGELACIÓN
La temperatura a la que una sustancia pasa del estado líquido al sólido.
PUNTO DE EBULLICIÓN
La temperatura a la que una sustancia pasa del estado líquido al estado gaseoso.
TEORÍA CUÁNTICA
Teoría desarrollada por varios físicos a partir de 1900, año en que Max Planck enuncia su revolucionaria teoría de los cuantos, que explica exitosamente la distribución de energía en una cavidad (cuerpo negro), problema que no tiene una solución si se intenta explicar a través de la física clásica o newtoniana.
RADIO ATÓMICO
En el caso de una molécula diatómica homonuclear, esto es, formada por dos átomos de la misma naturaleza, el radio atómico es la mitad de la distancia que separa los núcleos atómicos.
REACCIÓN QUÍMICA
Cambio en la materia en el que una o más sustancias químicas se transforman en sustancias químicas nuevas o diferentes.
REACCIÓN REVERSIBLE
Reacción química en la que la reacción inversa puede tener lugar de manera simultánea con la reacción directa.
REACTIVO
Sustancia de partida en una reacción química.
REDUCCIÓN
Proceso que significa, formalmente, la captación de uno o más electrones por parte de un átomo o grupo de átomos. Se dice que éste o éstos se reduce(n).
SALES
Compuestos químicos conformados por un catión y un anión, unidos por atracción eléctrica.
SEMIRREACCIÓN
Es un proceso en que imaginariamente transcurre produciéndose en él la oxidación o la reducción de un átomo en una reacción redox.
SISTEMA
Región del universo separado de éste por un borde o límite, real o imaginario.
SISTEMA ABIERTO
Es todo sistema que permite transferencia de masa y energía con el entorno.
SISTEMA AISLADO
Se denomina así a todo sistema que no intercambia materia ni energía con el alrededor.
SISTEMA CERRADO
Un sistema cerrado sólo intercambia energía con el alrededor.
SISTEMA NO REACTIVO
Sistema que respecto de un proceso determinado no sufre transformación química.
SUSTITUCIÓN NUCLEOFÍLICA
Reacción iniciada por un nucleófilo en la que éste reacciona con un sustrato o reactante reemplazando un átomo que es expulsado como anión.
TABLA PERIÓDICA
Tabla en la que los elementos, clasificados en orden de número atómico creciente, se sitúan de manera tal que los que poseen propiedades similares se hallan cerca unos de otros.
TEMPERATURA
Es una variable de estado, que según el modelo cinético-molecular es una medida de la energía cinética o grado de agitación de las moléculas.
UNIDAD DE FÓRMULA
Grupo de átomos o iones representados por la fórmula química de un compuesto; la unidad más sencilla de un compuesto iónico.
UNIDAD DE MASA ATÓMICA
(uma) Unidad de masa igual a 1/12 de la masa del núcleo de carbono-12, que es
1,66053873 × 10-27 kg ± 0,00000013 × 10-27 kg. Abreviatura uma.
VOLT
Es la diferencia de potencial eléctrico entre dos puntos de un alambre conductor por el que circula una corriente constante de 1 ampere, cuando la potencia disipada entre sus puntos es de 1 watt.
http://ciencias.huascaran.edu.pe/modulos/m_pilas/glosario.htm












![]()